Aktiva ingredienser: Eflornithine
Vaniqa 11,5% grädde (eflornitin)
Indikationer Varför används Vaniqa? Vad är det för?
Vaniqa innehåller den aktiva substansen eflornitin. Eflornitin bromsar hårväxten genom dess effekt på ett specifikt enzym (ett protein i kroppen som är involverat i hårproduktion).
Vaniqa används för att minska oönskad hårväxt (hirsutism) i ansiktet på kvinnor över 18 år.
Kontraindikationer När Vaniqa inte ska användas
Använd inte Vaniqa:
- om du är allergisk (överkänslig) mot eflornitin eller mot något annat innehållsämne som anges i avsnitt 6.
Försiktighetsåtgärder vid användning Vad du behöver veta innan du tar Vaniqa
Var försiktig med Vaniqa särskilt
- Innan du använder Vaniqa, berätta för din läkare om andra problem du har (särskilt om det är relaterat till dina njurar eller lever).
- om du är osäker på om du ska använda detta läkemedel eller inte, kontakta din läkare eller apotekspersonal för råd.
Överdriven hårväxt kan vara manifestationen av en underliggande sjukdom. Tala med din läkare om du har polycystiskt ovariesyndrom (SOP), om du har tumörer som producerar ett specifikt hormon eller om du tar läkemedel som kan framkalla hårväxt, t.ex. cyklosporin (efter en organtransplantation).), Glukokortikoider (för exempel som behandling för reumatiska eller allergiska sjukdomar), minoxidil (för högt blodtryck), fenobarbital (för anfall), fenytoin (för kramper) eller hormonersättningsterapi med effekter som liknar de hos manliga hormoner.
Barn
Vaniqa rekommenderas inte för personer under 18 år.
Interaktioner Vilka läkemedel eller livsmedel kan förändra effekten av Vaniqa
Tala om för din läkare eller apotekspersonal om du tar eller nyligen har tagit andra läkemedel, även receptfria sådana.
Tala med din läkare om du behöver använda andra läkemedel på den hudyta där du använder krämen.
Varningar Det är viktigt att veta att:
Graviditet och amning
Använd inte detta läkemedel om du är gravid eller ammar. Om du är gravid eller försöker bli gravid bör du använda en alternativ metod för behandling av ansiktshår.
Köra och använda maskiner
Ingen effekt av Vaniqa på förmågan att framföra fordon och använda maskiner förväntas.
Viktig information om några av ingredienserna i Vaniqa
Läkemedlet innehåller cetostearylalkohol och stearylalkohol, vilket kan orsaka lokala hudreaktioner (t.ex. kontaktdermatit). Den innehåller också metylparahydroxibensoat (E218) och propylparahydroxibensoat (E216) som kan orsaka allergiska reaktioner (möjligen försenad typ).
Dos, metod och administreringstid Hur man använder Vaniqa: Dosering
Använd alltid Vaniqa enligt läkarens anvisningar. Fråga din läkare eller apotekspersonal om du är osäker.
- Du använder den två gånger om dagen, med minst 8 timmars mellanrum.
- Om du utvecklar irritation (t.ex. en brännande eller stickande känsla), minska användningen av Vaniqa till en gång om dagen tills irritationen avtar. Kontakta din läkare om irritationen kvarstår.
- Om du precis har rakat eller använt andra hårborttagningsmedel, vänta minst 5 minuter innan du använder Vaniqa. Att applicera krämen på skadad eller irriterad hud kan orsaka stickande eller brännande känsla.
- Rengör och torka huden som du kommer att använda grädden på.
- Applicera ett tunt lager grädde och massera kraftigt tills någon synlig rest av produkten på de behandlade områdena försvinner.
- Om möjligt, tvätta inte dessa delar av huden i 4 timmar efter applicering av krämen.
- Tvätta händerna efter applicering av krämen.
- Vänta minst 5 minuter innan du använder ansiktsmakeup eller solskyddsmedel på samma område.
- Om du använder det i ansiktet, undvik kontakt med ögonen eller med näshålans och munhålan. Skulle Vaniqa av misstag komma i kontakt med ögonen, näsan eller munnen, skölj noggrant med vatten.
Vaniqa är inte en hårborttagningskräm, så du kan behöva fortsätta använda din vanliga metod för hårborttagning, till exempel rakning eller plockning.
Resultaten kan ta 8 veckor att vänta, under vilken tid det är viktigt att fortsätta använda krämen. Om du inte ser någon förbättring efter att ha använt den på 4 månader, kontakta din läkare. Om du slutar applicera krämen kan hårväxten återgå till normal. initiala nivåer över 8 veckor.
Överdosering Vad du ska göra om du har tagit för mycket Vaniqa
Om du har använt för stor mängd av Vaniqa
Om du lägger för mycket grädde på din hud är det osannolikt att det kommer att skada dig.
Kontakta din läkare omedelbart om du eller någon annan av misstag sväljer Vaniqa.
Om du har glömt att använda Vaniqa
Applicera produkten omedelbart, men vänta minst 8 timmar innan du upprepar applikationen.
Om du slutar att ta Vaniqa
För att upprätthålla minskningen av hårväxt fortsätter du att använda Vaniqa utan avbrott enligt instruktionerna.
Fråga din läkare eller apotekspersonal om du har ytterligare frågor om användningen av detta läkemedel.
Biverkningar Vilka är biverkningarna av Vaniqa
Liksom alla läkemedel kan Vaniqa orsaka biverkningar men alla användare behöver inte få dem.
Vanligtvis är biverkningarna begränsade till huden och av mild intensitet. I dessa fall löser de vanligtvis utan att avbryta Vaniqa.
Frekvensen av möjliga biverkningar som anges nedan definieras med följande konvention:
Mycket vanliga (drabbar fler än 1 av 10 patienter)
Vanliga (drabbar 1 till 10 användare av 100)
Mindre vanliga (drabbar 1 till 10 användare av 1000)
Sällsynta (drabbar mellan 1 och 10 av 10 000 patienter)
Mycket sällsynta (drabbar färre än 1 användare av 10 000)
Ingen känd frekvens (kan inte beräknas utifrån tillgängliga data).
Mycket vanliga (drabbar fler än 1 av 10 patienter)
- acne
Vanliga (drabbar 1 till 10 användare av 100)
- torrhet i huden
- håravfall
- inflammation i hårstrået
- klia
- utbrott
- rodnad
- hudirritation och stötar orsakade av rakning
- hudirritation eller stickande, stickande eller brännande känsla på huden
Mindre vanliga (drabbar 1 till 10 användare av 1000)
- humpigt utslag (papulärt utslag)
- munsår
- rodnad och irritation vid appliceringen av krämen
- eksem
- inflammerade, torra, nariga eller domna läppar
- inåtväxande hårstrån
- blekt hudutslag
- blödande hud
- kokar
- hudspolning
- inflammation i huden
- ont i huden
- svullnad i munnen eller ansiktet
- onormal hårstruktur eller tillväxt
Sällsynta (drabbar mellan 1 och 10 av 10 000 patienter)
- onormal hudtillväxt (hudcancer)
- överdriven hårväxt
- rodnad, rodnad i ansiktet och kokar, eventuellt med pus
- andra hudsjukdomar
- inflammation i huden med rodnad, skalning och klåda (seborrheisk dermatit)
- utslag med rodnad, stötar eller blåsor
- hudcysta
- härdning av huden
Rapportering av biverkningar
Om du får några biverkningar, tala med din läkare, apotekspersonal eller sjuksköterska. Detta inkluderar eventuella biverkningar som inte anges i denna bipacksedel. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet som anges i bilaga V. Du kan hjälpa till ge mer information om säkerheten för detta läkemedel
Giltighetstid och lagring
Förvaras utom syn- och räckhåll för barn.
Använd inte Vaniqa efter utgångsdatumet som anges på kartongen och vid tubens botten efter EXP. Utgångsdatumet avser sista dagen i månaden.
Se till att rörlocket är ordentligt stängt efter varje användning.
Förvaras vid högst 25 ° C.
Läkemedel ska inte kastas i avloppsvatten eller hushållsavfall. Fråga din apotekare hur du ska kasta läkemedel som du inte använder längre. Detta hjälper till att skydda miljön.
Sammansättning och läkemedelsform
Vad Vaniqa innehåller
Den aktiva ingrediensen i Vaniqa är eflornitin. Varje gram grädde innehåller 115 mg eflornitin (hydrokloridmonohydrat).
Hjälpämnen är:
cetostearylalkohol, makrogol cetostearyleter, dimetikon, glycerylstearat, makrogolstearat, metylpara-hydroxibensoat (E218), flytande paraffin, fenoxietanol, propylpara-hydroxibensoat (E216), renat vatten och stearylalkohol. I vissa fall tillsätts små mängder natriumhydroxid (E524) för att bibehålla normala surhetsnivåer (pH -nivåer).
Beskrivning av hur Vaniqa ser ut och förpackningens innehåll
Vaniqa är en vit till benvit kräm. Den levereras i rör om 15 g, 30 g och 60 g men alla förpackningsstorlekar kanske inte saluförs.
Bipacksedel: AIFA (Italian Medicines Agency). Innehåll publicerat i januari 2016. Den information som finns finns kanske inte uppdaterad.
För att få tillgång till den senaste versionen är det lämpligt att gå till AIFA (Italian Medicines Agency) webbplats. Ansvarsfriskrivning och användbar information.
01.0 LÄKEMEDLETS NAMN
VANIQA 11,5% CREAM
02.0 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
Varje gram grädde innehåller 115 mg eflornitin (hydrokloridmonohydrat).
Hjälpämnen:
Varje gram grädde innehåller 47,2 mg cetostearylalkohol, 14,2 mg stearylalkohol, 0,8 mg metylparahydroxibensoat och 0,32 mg propylparahydroxibensoat.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
03.0 LÄKEMEDELSFORM
Grädde.
Vit till benvit grädde.
04.0 KLINISK INFORMATION
04.1 Terapeutiska indikationer
Behandling av ansikts hirsutism hos kvinnor.
04.2 Dosering och administreringssätt
Dosering
Vaniqa -kräm ska appliceras på det drabbade området två gånger om dagen, med minst åtta timmars mellanrum.
Effekten har endast visats för de drabbade områdena i ansiktet och under hakan. Applicering bör begränsas till dessa områden. De maximalt applicerade doserna som användes säkert i kliniska prövningar var upp till 30 gram per månad.
En förbättring av tillståndet kan ses inom 8 veckor efter behandlingsstart.
Kontinuerlig behandling kan möjliggöra ytterligare förbättringar och är nödvändig för att bibehålla de fördelaktiga effekterna.
Situationen kan återgå till nivåerna före behandlingen inom åtta veckor efter avslutad behandling.
Om inga positiva effekter ses inom 4 månader efter att behandlingen påbörjats, ska användningen avbrytas.
Patienter kan behöva fortsätta använda epileringsmedel (t.ex. mekanisk rakning eller epilering) i kombination med Vaniqa. I detta fall bör krämen appliceras tidigast fem minuter efter rakning eller med andra metoder. Hårborttagning, som en ökning brännande eller stickande känsla kan förekomma.
Särskilda populationer
Äldre (> 65 år): ingen dosjustering krävs.
Pediatrisk population: Säkerhet och effekt för Vaniqa hos flickor i åldrarna 0-18 år har inte fastställts. Det finns inga tillgängliga data för att stödja dess användning i denna åldersgrupp.
Lever / njurinsufficiens: Vaniqas säkerhet och effekt hos kvinnor med lever- eller njurinsufficiens har inte fastställts Eftersom Vaniqas säkerhet inte har studerats hos patienter med svår njurinsufficiens bör Vaniqa ordineras med försiktighet till sådana patienter. Inga data finns tillgängliga.
Administreringssätt
Ett tunt lager kräm ska appliceras på de rena och torra drabbade områdena. Krämen ska masseras noggrant. Läkemedlet måste appliceras på ett sådant sätt att det efter massagen inte märks några rester av produkten i de behandlade områdena. Tvätta händerna efter applicering av läkemedlet. För maximal effektivitet bör området inte rengöras inom fyra timmar efter applicering. Kosmetika (inklusive solskyddsmedel) kan appliceras på det behandlade området, men tidigast fem timmar. Minuter efter applicering.
04.3 Kontraindikationer
Överkänslighet mot eflornitin eller mot något hjälpämne (se avsnitt 6.1).
04.4 Särskilda varningar och lämpliga försiktighetsåtgärder vid användning
Överdriven hårväxt kan bero på allvarliga icke-uppenbara sjukdomar (t.ex.: polycystiskt äggstockssyndrom, sekretorisk androgen neoplasma) eller några aktiva ingredienser (t.ex.: cyklosporin, glukokortikoider, minoxidil, fenobarbiton, fenytoin, kombinerad hormonersättningsterapi östrogen androgen).
Dessa faktorer måste beaktas som en del av den medicinska behandlingen av patienter som kan ordineras Vaniqa.
Vaniqa är endast för kutan användning. Undvik kontakt med ögon eller slemhinnor (t.ex. näsa eller mun). Övergående stickande eller stickande känslor kan uppstå när krämen appliceras på nötad eller sårad hud.
Vid hudirritation eller utveckling av intolerans bör frekvensen av applikationer tillfälligt reduceras till en gång om dagen. Om irritationen kvarstår ska behandlingen avbrytas och en läkare rådfrågas.
Läkemedlet innehåller cetostearylalkohol och stearylalkohol, vilket kan orsaka lokala hudreaktioner (t.ex. kontaktdermatit) och metylparahydroxibensoat och propylparahydroxibensoat som kan orsaka allergiska reaktioner (möjligen fördröjd typ).
04.5 Interaktioner med andra läkemedel och andra former av interaktion
Inga interaktionsstudier har utförts.
04.6 Graviditet och amning
Graviditet:
Data från alla kliniska studier om ett begränsat antal exponerade graviditeter tyder på att det inte finns några kliniska bevis för att behandling med Vaniqa påverkar mödrar eller foster negativt. Av de 22 graviditeter som inträffade under studierna inträffade endast 19 medan patienten använde Vaniqa. Bland dessa 19 graviditeter fanns det 9 friska spädbarn, 5 elektiva aborter, 4 missfall och en nyfödd defekt (Downs syndrom hos en 35-årig kvinna). Hittills finns inga andra relevanta epidemiologiska data tillgängliga. Djurstudier har visat reproduktionstoxicitet (se avsnitt 5.3). Den potentiella risken för människor är okänd. Därför bör kvinnor som är gravida eller planerar att bli gravida använda ett annat system för att behandla ansikts hirsutism.
Matdags:
Det är inte känt om eflornitin utsöndras i bröstmjölk.Kvinnor ska inte använda Vaniqa under amning.
Fertilitet:
Inga data finns tillgängliga.
04.7 Effekter på förmågan att framföra fordon och använda maskiner
Vaniqa har ingen eller försumbar påverkan på förmågan att framföra fordon eller använda maskiner.
04.8 Biverkningar
De mest rapporterade kutana biverkningarna var i huvudsak milda i intensitet och försvann utan avbrott av Vaniqa eller påbörjande av medicinsk behandling. Den vanligast rapporterade biverkningen var akne, som i allmänhet var mild. I fordonskontrollerade studier (n = 596) upptäcktes akne vid baslinjen hos 41% av patienterna; 7% av patienterna som behandlades med Vaniqa och 8% av de som behandlades med enbart vehikel upplevde en försämring av tillståndet. Av dem utan akne vid baslinjen rapporterade en liknande andel (14%) akne efter behandling med Vaniqa eller ensam.
Följande lista visar frekvensen av kutana biverkningar som observerats i kliniska studier, enligt MedDRA -konventionen. MedDRA -konventioner för frekvens är: mycket vanliga (≥1 / 10), vanliga (≥1 / 100, erytem rapporterades oftare bland patienter som behandlats med Vaniqa än med enbart vehikel, vilket indikeras av "(*).
Frekvens av kutana biverkningar observerade i kliniska studier med Vaniqa (enligt MedDRA -frekvenskonventionen).
Störningar i huden och subkutan
Mycket vanliga (≥1 / 10):
Acne
Vanliga (≥1 / 100 ,:
Skäggpseudofollikulit, alopeci, stickande känsla *, brännande hud *, torr hud, klåda, erytem *, stickningar *, hudirritation, utslag *, follikulit
Mindre vanliga (≥1 / 1.000 ,:
Inväxt hår, ansiktsödem, dermatit, munödem, papulära utslag, hudblödning, herpes simplex, eksem, cheilit, furunkulos, kontaktdermatit, onormal hårstruktur och tillväxt, hypopigmentering, hudrödhet med värme, domningar i läppar, hud ömhet
Sällsynta (≥1 / 10 000 ,:
Rosacea, seborrheisk dermatit, hudneoplasmer, makulopapulära utslag, hudcystor, vesikulobullousutslag, hudsjukdomar, hirsutism, hudtäthet
Pediatrisk population
Biverkningar som observerats hos ungdomar liknar de som ses hos vuxna kvinnor.
04.9 Överdosering
Med tanke på den minimala hudgenomträngningen av eflornitin (se avsnitt 5.2) är en överdosering mycket osannolik, men vid dermal administrering av en hög dos eller vid oavsiktligt intag bör man uppmärksamma effekterna som observerats med terapeutiska doser av eflornitin. administreras intravenöst (400 mg / kg / dag eller cirka 24 g / dag) vid behandling av Trypanosoma brucei gambiensis (Afrikansk letargisk encefalit): håravfall, svullnad i ansiktet, anfall, hörselstörningar, gastrointestinala störningar, aptitlöshet, huvudvärk, svaghet, yrsel, anemi, trombocytopeni, leukopeni.
Om symtom på överdosering uppstår ska användning av läkemedlet avbrytas.
05.0 FARMAKOLOGISKA EGENSKAPER
05.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: andra dermatologiska preparat. ATC -kod: D11A X16.
Eflornitin hämmar irreversibelt ornitindekarboxylas, ett enzym som är involverat i produktionen av håraxeln av follikeln. Vaniqa har visat sig minska hårväxthastigheten.
Vaniqas säkerhet och effekt jämfört med enbart fordon utvärderades i två randomiserade dubbelblinda kliniska prövningar på 596 kvinnor med typ I-VI-hud (395 på Vaniqa, 201 på fordon ensam) behandlade i upp till 24 Läkarna bedömde förändringen från baslinje på en 4-punkts skala 48 timmar efter att kvinnorna hade rakat de behandlade områdena i de drabbade delarna av ansiktet och under hakan, med tanke på parametrar som hårlängd och hårlängd, densitet och mörkare hud i samband med närvaro av terminal hår. En förbättring observerades 8 veckor efter behandlingsstart.
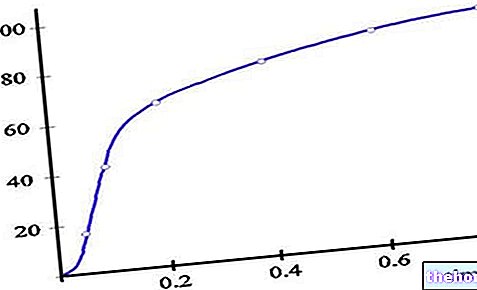
De kombinerade resultaten av dessa två studier presenteras nedan:
* I slutet av behandlingen (24: e veckan). För patienter som avbröt behandlingen under studien gjordes den senaste observationen i vecka 24. En statistiskt signifikant (p ≤0,001) förbättring för Vaniqa jämfört med enbart fordonet observerades i var och en av dessa studier för kvinnor med svar som markant förbättring eller tydlig / nästan klar. Dessa förbättringar ledde till en motsvarande minskning av den skenbara mörkningen av ansiktshuden i samband med närvaron av terminal hår. Undergruppsanalyser visade en skillnad i behandlingsframgång, 27% av icke-vita kvinnor och 39% av vita kvinnor visade markant eller större förbättring. Undergruppsanalyser visade också att 29% av fetma kvinnor (BMI ≥30) och 43% av kvinnor med normal vikt (postmenopausalt BMI. Betydande förbättring (p klimakteriet.
Patientens självbedömning visade en signifikant minskning av psykisk nöd associerad med tillståndet, mätt genom svar på 6 frågor på en visuell analog skala.Vaniqa minskade signifikant patienternas obehag med ansiktshår och den tid det tog att ta bort, behandla eller dölja dem. Patientens välbefinnande i vissa sociala situationer eller arbetssituationer förbättrades också.Patientens självbedömningar korrelerade med läkarens observationer av effekt. Dessa patient observerbara skillnader var synliga efter 8 veckors behandling.
Situationen återgick till nivåerna före behandlingen inom åtta veckor efter avslutad behandling.
05.2 "Farmakokinetiska egenskaper
Steady-state dermal penetration av eflornitin, administrerat som Vaniqa till rakad ansiktshud hos kvinnor, var 0,8%.
Halveringstiden för eflornitin vid steady state är cirka 8 timmar. Steady state uppnås inom fyra dagar. Topp- och dalplasmakoncentrationer av eflornitin var cirka 10 ng / ml respektive 5 ng / ml. Vid steady state var området under plasmakoncentration-tidskurvan vid 12 timmar 92,5 ng / timme / ml.
Eflornitin är inte känt för att metaboliseras.Eflornitin elimineras främst i urinen.
05.3 Prekliniska säkerhetsdata
Baserat på konventionella studier av toxicitet vid upprepade doser, gentoxicitet och potentiell cancerframkallande, inklusive en fotokarcinogenicitetsstudie på möss, avslöjar prekliniska data ingen särskild fara för människor.
I en dermal fertilitetsstudie på råttor fanns inga negativa effekter på fertiliteten upp till 180 gånger de doser som användes hos människor.
I dermatiska teratologiska studier observerades inga teratogena effekter hos råttor och kaniner i doser upp till 180 respektive 36 gånger de som användes hos människor. Högre doser gav maternell och fostertoxicitet utan tecken på teratogenicitet.
06.0 LÄKEMEDELSINFORMATION
06.1 Hjälpämnen
Cetostearylalkohol; makrogol cetostearyleter; dimetikon; glycerylstearat; makrogolstearat; metylpara-hydroxibensoat (E218); flytande paraffin; fenoxietanol; propylpara-hydroxibensoat (E216); renat vatten; stearylalkohol; natriumhydroxid (E524) (för att justera pH).
06.2 Oförenlighet
Inte relevant.
06.3 Giltighetstid
3 år.
06.4 Särskilda förvaringsanvisningar
Förvaras vid temperaturer som inte överstiger 25 ° C.
06.5 Förpackningens innehåll och förpackningens innehåll
Högdensitetsrör av polyeten, med skruvlock av polypropen, innehållande 15 g, 30 g eller 60 g grädde. Alla förpackningsstorlekar kanske inte marknadsförs.
06.6 Anvisningar för användning och hantering
Oanvänd medicin och avfall från detta läkemedel måste kasseras i enlighet med lokala föreskrifter.
07.0 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Almirall SA - Ronda General Mitre 151, 08022 Barcelona - Spanien
08.0 NUMMER FÖR FÖRSÄLJNINGSTILLSTÅND
EU/1/01/173/001 - AIC: 035115017
EU/1/01/173/002 - AIC: 035115029
EU/1/01/173/003 - AIC: 035115031
09.0 DATUM FÖR FÖRSTA GODKÄNNANDE ELLER FÖRNYELSE AV GODKÄNNANDET
Datum för det första godkännandet: 20 mars 2001
Datum för senaste förnyelse: 7 mars 2011
















.jpg)